
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:解答题
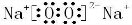 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

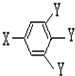 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)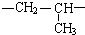
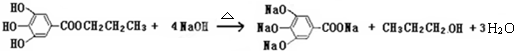
查看答案和解析>>
科目: 来源: 题型:解答题
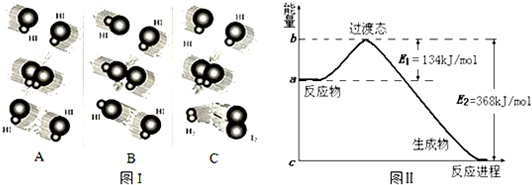
查看答案和解析>>
科目: 来源: 题型:解答题
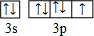 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.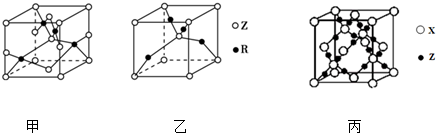
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX<H2Y<ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 离子半径:X->Y2->Z3- | D. | 原子序数:Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2和O3 | B. | ${\;}_{1}^{2}$H和${\;}_{1}^{2}$H | ||
| C. | 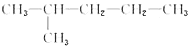 和CH3-CH2-CH2-CH2-CH2-CH3 和CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
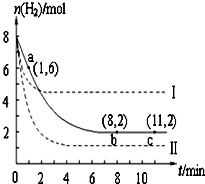 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com