
科目: 来源: 题型:选择题
| A. | 煤中存在苯、二甲苯,工业上可由煤蒸馏获得 | |
| B. | 直馏汽油和裂化汽油中分别加入溴的四氯化碳溶液均能发生化学反应 | |
| C. | 石油的裂化、裂解和煤的干馏、气化都属于化学变化 | |
| D. | 石油裂解是生产乙烯的主要方法,乙烯和聚乙烯均能使溴水发生反应而褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | 只有②③⑤ | C. | 只有③④⑥ | D. | 只有①②③⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率理论可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理论可指导怎样使用有限原料多出产品 | |
| C. | 当反应达到限度时,无论外界条件如何变化,反应体系内各物质含量始终不变 | |
| D. | 正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
查看答案和解析>>
科目: 来源: 题型:选择题

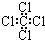
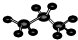
| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
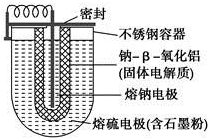 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Cl-、HCO3-、Ca2+ | B. | OH-、Na+、Mg2+、HCO3- | ||
| C. | Na+、Cl-、H+、Ag+ | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
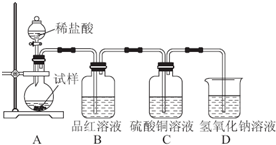
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com