
科目: 来源: 题型:解答题
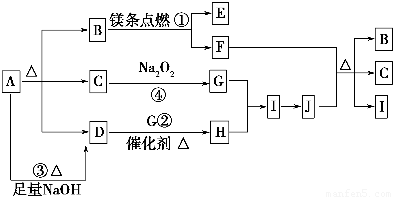
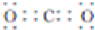 .
.查看答案和解析>>
科目: 来源: 题型:解答题

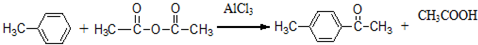
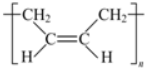 .
. .
. .
.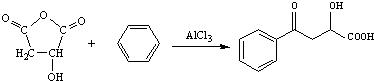 .
.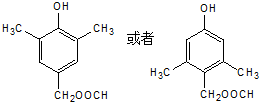 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
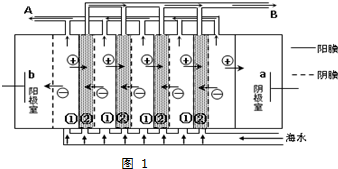
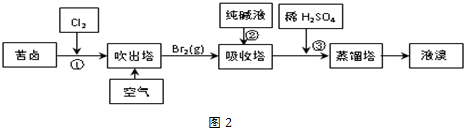
查看答案和解析>>
科目: 来源: 题型:解答题
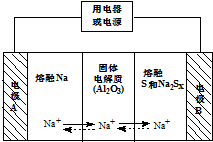 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目: 来源: 题型:解答题
 CH4和CO2可以制造价值更高的化学产品.已知:
CH4和CO2可以制造价值更高的化学产品.已知:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I- 可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50 mL该溶液与过量Zn充分反应,生成0.56 g Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com