
科目: 来源: 题型:解答题
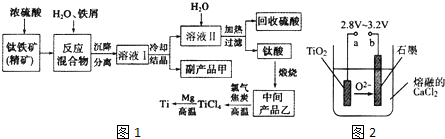
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
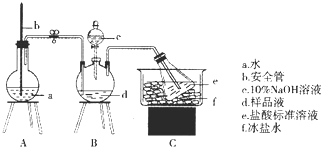
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 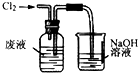 用装置甲氧化废液中的溴化钠 | B. | 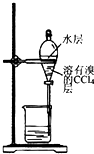 用装置乙分离CCl4层和水层 | ||
| C. |  用装置丙分离CCl4和液溴 | D. | 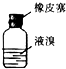 用仪器丁长期贮存液溴 |
查看答案和解析>>
科目: 来源: 题型:解答题
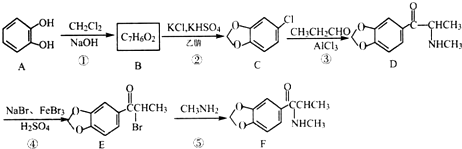
 .
. (填结构简式).
(填结构简式).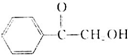 )的合成路线.
)的合成路线.查看答案和解析>>
科目: 来源: 题型:解答题

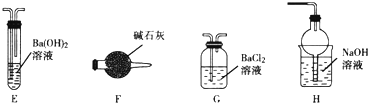
查看答案和解析>>
科目: 来源: 题型:选择题
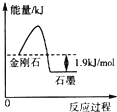 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 逸項 | 实驗操作及现象 | 实验结论 |
| A | 向某溶洧液中同时滴加几滴KSCN溶液和少量的新制氯水,溶液变成血红色 | 该溶液中一定含有Fe3+ |
| B | 将澄清石灰水滴入可能混有Na2CO3的 NaHCO3溶液中出现白色沉淀 | 该液中一定含有Na2CO3 |
| C | 常温下,用pH计测定某溶液NaHSO3溶液的 pH约为5.20 | 该溶液中HSO3-的电离程度大于它的水解程度 |
| D | 常温下,向某溶液中滴加稀NaOH溶液将湿润的红石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定不含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
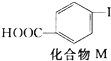 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$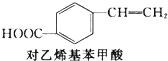 +HI
+HI| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | 14C可用于文物的鉴定,14C与12C互为同素异形体 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
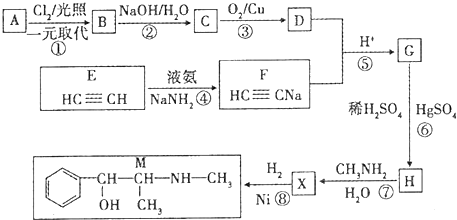
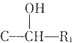
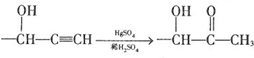
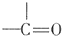 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$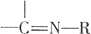
 .
.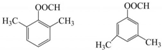 .
.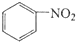 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$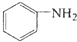 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体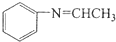 的路线
的路线 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com