
科目: 来源: 题型:解答题
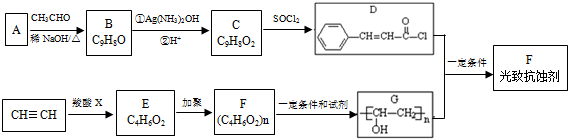
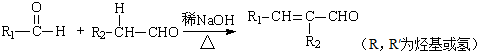
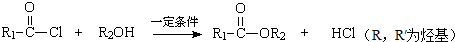
 .
.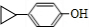 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
查看答案和解析>>
科目: 来源: 题型:选择题
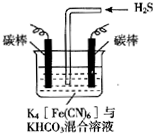 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
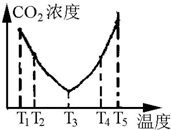
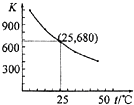 已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680 |
查看答案和解析>>
科目: 来源: 题型:选择题
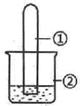 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
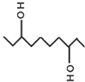
| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
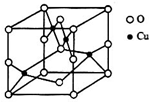 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com