
科目: 来源: 题型:解答题
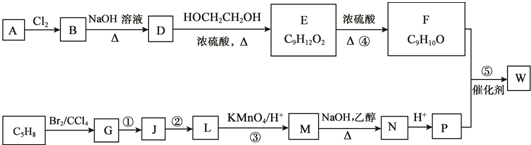
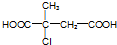 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.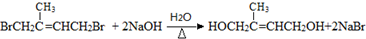 .
. .
.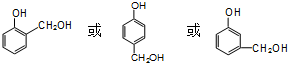 .
.查看答案和解析>>
科目: 来源: 题型:解答题
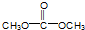 简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下:
简称DMC)是油漆、胶粘剂行业的环保型绿色溶剂.DMC的合成方法很多,如以乙烯为原料,与甲醇进行酯交换的合成路线如下: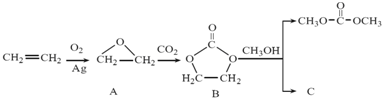

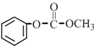 ;
;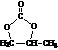 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)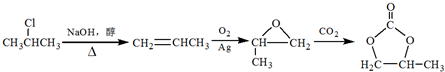 .合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.
.合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物.查看答案和解析>>
科目: 来源: 题型:解答题
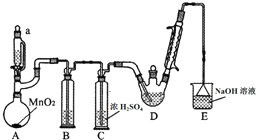 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |

查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
查看答案和解析>>
科目: 来源: 题型:选择题
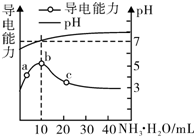 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )| A. | HR为强酸 | |
| B. | 加入10 mL 氨水时,溶液中c(NH4+)>c(R-) | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b点的离子浓度大于a点的离子浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 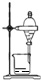 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 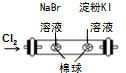 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 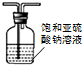 所示装置,除去SO2中混有的少量HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com