
科目: 来源: 题型:选择题
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
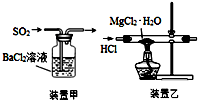
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: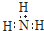 | |
| C. | 苯乙酸钠的结构简式: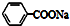 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
查看答案和解析>>
科目: 来源: 题型:解答题
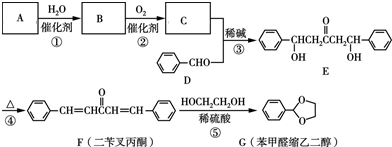
 +2
+2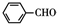 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$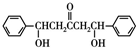 .
.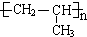 .
.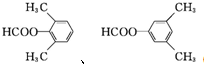 .
. (无机物任选).
(无机物任选).查看答案和解析>>
科目: 来源: 题型:解答题
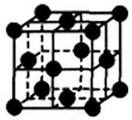 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
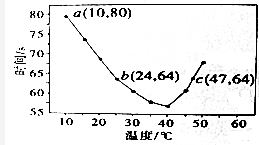
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com