
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目: 来源: 题型:填空题
 某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:
某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:查看答案和解析>>
科目: 来源: 题型:填空题
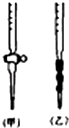 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在中和滴定实验中,锥形瓶须用待测液润洗 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高 | |
| D. | 滴定时可将KMnO4溶液装在碱式滴定管中 |
查看答案和解析>>
科目: 来源: 题型:解答题
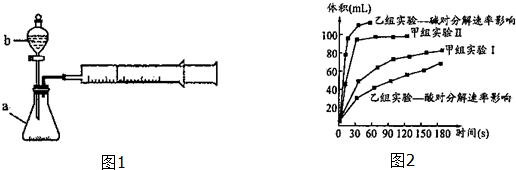
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com