
科目: 来源: 题型:选择题
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
查看答案和解析>>
科目: 来源: 题型:多选题
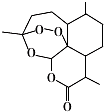
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 12月2日我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
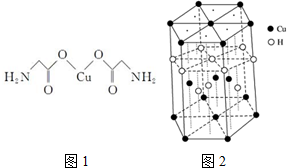
查看答案和解析>>
科目: 来源: 题型:解答题
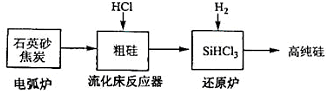
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
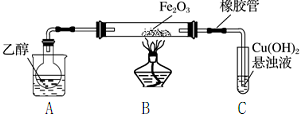
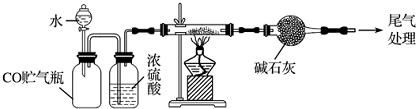
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com