
科目: 来源: 题型:多选题
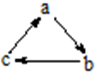 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HCl | H2CO3 | HClO |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:解答题

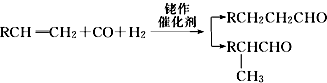
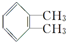 ,名称为邻二甲苯.
,名称为邻二甲苯. .
.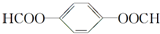 ; 1molX与NaOH溶液共热反应,最多消耗4molNaOH.
; 1molX与NaOH溶液共热反应,最多消耗4molNaOH.查看答案和解析>>
科目: 来源: 题型:解答题
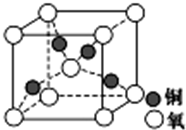 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破.用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破.用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:查看答案和解析>>
科目: 来源: 题型:解答题
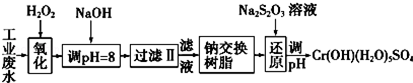
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com