
科目: 来源: 题型:解答题
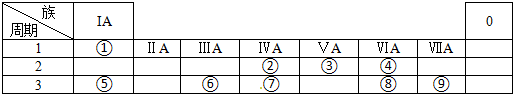
 ,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).
,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).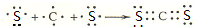 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| E | A | |||
| B | C | D |
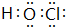 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.查看答案和解析>>
科目: 来源: 题型:解答题

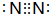 ;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
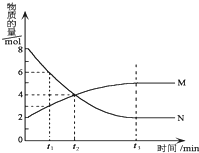 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池工作一段时间后,KOH溶液的质量分数不变 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 该燃料电池可以用两个活性相同的电极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 离子半径r(R3-)>r(X+)>r(Z3+) | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | Y的含氧酸的酸性一定比R的含氧酸的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com