
科目: 来源: 题型:选择题
| A. | 100mL1mol/LNa2CO3溶液中含有0.1NA个CO32- | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| C. | 1molCl2与过量Fe反应,转移的电子数为2 NA | |
| D. | 标准状况下,11.2L乙醇完全燃烧产生二氧化碳分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
查看答案和解析>>
科目: 来源: 题型:填空题
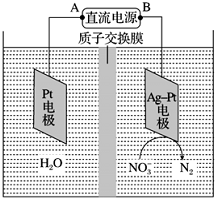 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示.查看答案和解析>>
科目: 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C≡0 | H-O |
| 键能(kJ•mol-1) | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
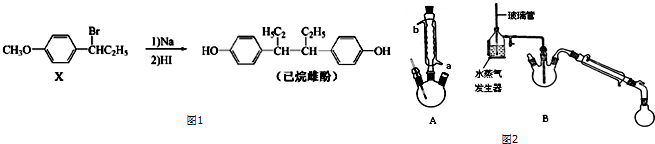
 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.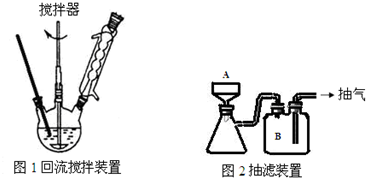
查看答案和解析>>
科目: 来源: 题型:解答题
 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
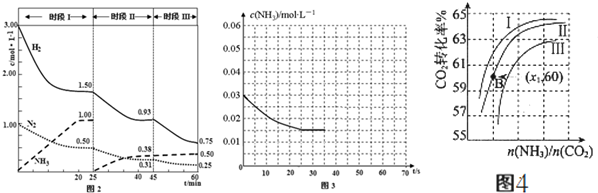
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下: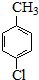 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
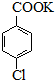 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$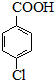
| 熔点/℃ | 沸点/℃ | 密度/g•cmˉ3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐,溶解度随温度升高而增大 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com