
科目: 来源: 题型:选择题
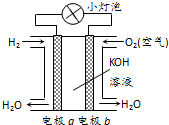
| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的电子式 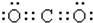 | |
| B. | Cl-的结构示意图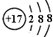 | |
| C. | NaOH的电子式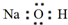 | |
| D. | 原子核内有20个中子的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
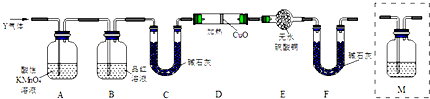
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯原子的结构示意图: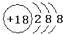 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: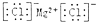 | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+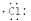 →H+ →H+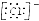 |
查看答案和解析>>
科目: 来源: 题型:解答题
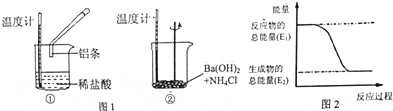
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com