
科目: 来源: 题型:解答题
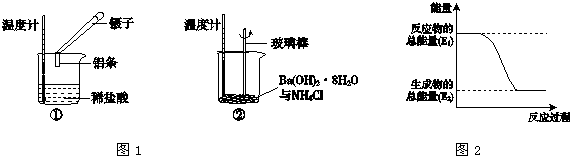
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属性强弱:X>Y>Z | B. | 原子序数大小:X<Y<Z | ||
| C. | 原子半径大小:X<Y<Z | D. | 原子最外层电子数:X>Y>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应容器中压强不再变化 | |
| B. | X的分解速率与X的生成速率相等 | |
| C. | X、Y、Z的浓度之比为2:1:1 | |
| D. | 单位时间内生成1molY的同时生成1molZ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 开发太阳能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 推广使用乙醇汽油,尽量减少污染 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗、增加资源的重复使用及资源的循环再生 |
查看答案和解析>>
科目: 来源: 题型:解答题
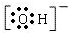 .
.查看答案和解析>>
科目: 来源: 题型:解答题
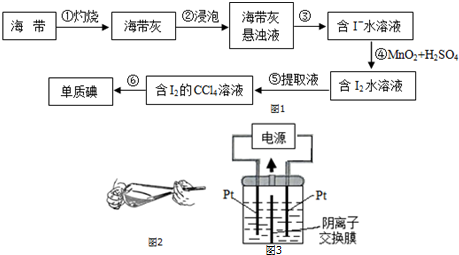
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目: 来源: 题型:解答题
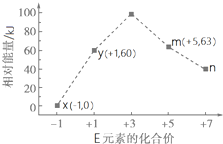 下表给出五种短周期元素的相关信息.
下表给出五种短周期元素的相关信息.| 元素 | 相关信息 |
| A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com