
科目: 来源: 题型:选择题
| A. | 最终可生成0.2 mol NH3 | |
| B. | 增大压强能使反应速率减小 | |
| C. | 降低反应体系的温度能加快反应速率 | |
| D. | 向容器中再加入N2,能加快反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | CO作还原剂 | ||
| C. | Fe2O3发生氧化反应 | D. | CO被还原 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化钠的电子式: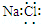 | |
| B. | 聚乙烯的结构简式: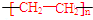 | |
| C. | 硫离子的结构示意图: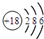 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
查看答案和解析>>
科目: 来源: 题型:解答题
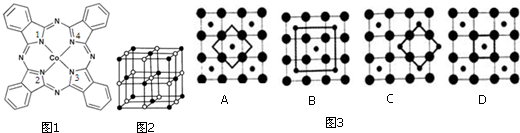
查看答案和解析>>
科目: 来源: 题型:解答题
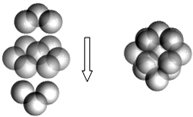 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:查看答案和解析>>
科目: 来源: 题型:解答题
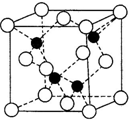 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键叫离子键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的酸性逐渐增强 | B. | 铜片逐渐溶解 | ||
| C. | 溶液中H+向锌片作定向移动 | D. | 锌片是负极并被氧化 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com