
科目: 来源: 题型:选择题
| A. | 次氯酸的电子式 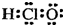 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为92,中子数为143的铀原子:23592U | |
| D. | NH4I的电子式: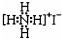 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr | B. | 原子半径:Na>S>O | ||
| C. | 元素金属性:Na>Mg>Al | D. | 酸性:H3PO4>H2SO4>HClO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2-己烯能使KMnO4(H+)溶液褪色 | |
| B. | 汽油、煤油、柴油和植物油都是碳氢化合物 | |
| C. | 乙烯、苯都可与溴水发生加成反应 | |
| D. | 乙烯和聚乙烯都能发生加聚反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
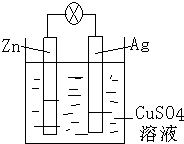 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com