
科目: 来源: 题型:解答题
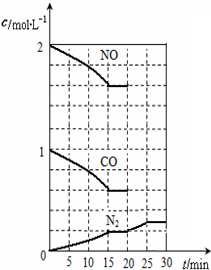 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
科目: 来源: 题型:解答题
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
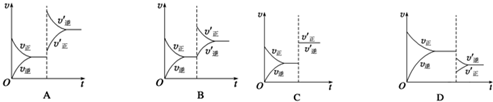
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、O2中 | B. | SO3、SO2中 | C. | SO3中 | D. | SO3、SO2、O2中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目: 来源: 题型:推断题
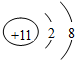 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com