
科目: 来源: 题型:解答题
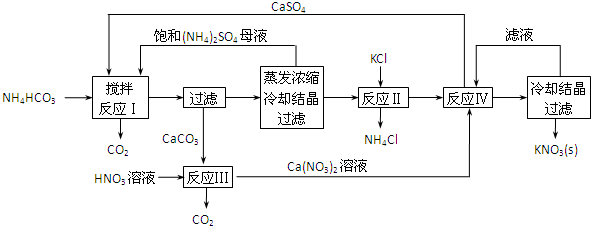
查看答案和解析>>
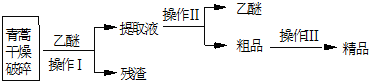
科目: 来源: 题型:解答题
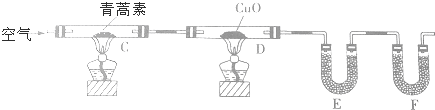
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在氧气中燃烧,钠的氧化产物: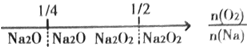 | |
| B. | 铁在Cl2中燃烧,铁的氧化产物: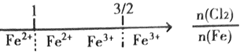 | |
| C. | A1Cl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: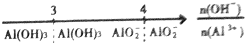 | |
| D. | FeI2溶液中通入Cl2,铁元素存在形式: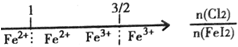 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 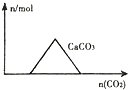 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 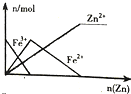 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 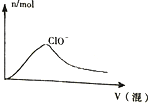 HCl与Cl2的混合通入NaOH溶液中 |
查看答案和解析>>
科目: 来源: 题型:解答题
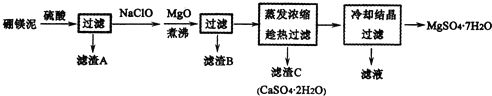
查看答案和解析>>
科目: 来源: 题型:解答题
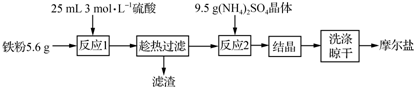
查看答案和解析>>
科目: 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
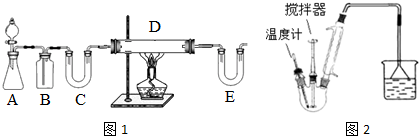
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com