
科目: 来源: 题型:选择题
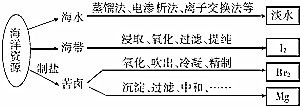
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目: 来源: 题型:选择题
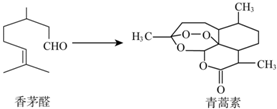 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目: 来源: 题型:实验题
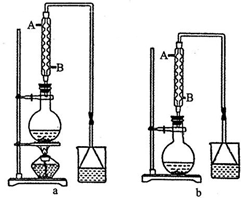 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
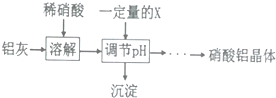
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com