
科目: 来源: 题型:选择题
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 铝片与浓硫酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电子层数:P<S<Cl | B. | 最高正化合价:N<O<F | ||
| C. | 原子半径:C<N<O | D. | 金属性:Na>Mg>Al |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
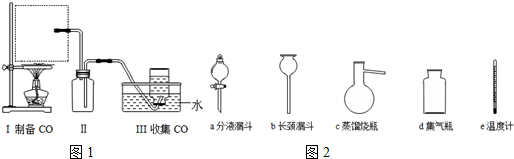
查看答案和解析>>
科目: 来源: 题型:解答题
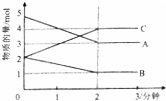 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒) 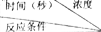 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
查看答案和解析>>
科目: 来源: 题型:解答题
 CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.
CH3CH2COONH4+3NH3+2Ag+H2O.在此过程中丙醛发生氧化(氧化、还原)反应,此反应可以检验醛基的存在.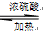 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.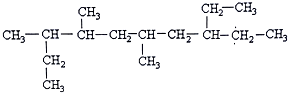
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com