
科目: 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大 | |
| D. | 所有主族元素的原子形成单核离子时的价数都和它的族数相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
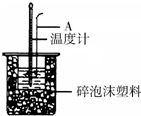 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
.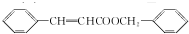 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
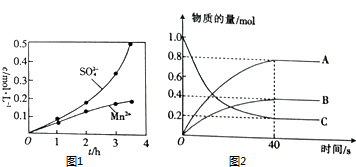 硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:
硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
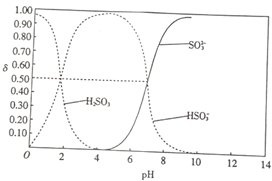 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
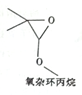
| A. | 该有机物能与金属钠反应 | |
| B. | 该有机物的分子式为C5H9O2 | |
| C. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 | |
| D. | 该有机物的同分异构体(不考虑立体异构体)中,能水解生成羧酸与醇的物质共有9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com