
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 一定条件下,使用催化剂能加快反应速率和提高反应物转化率 | |
| B. | 常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变 | |
| C. | 在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量 | |
| D. | 在密闭绝热的容器中发生2SO2+O2?2SO3反应,当反应容器温度恒定时,反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
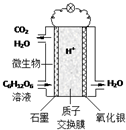 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
查看答案和解析>>
科目: 来源: 题型:选择题
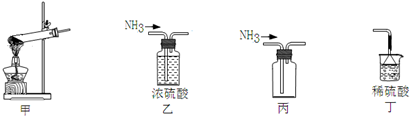
| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3$→_{催化剂、加热}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCi(aq)}{→}$MgCl2(aq)$\stackrel{△}{→}$ 无水MgCl2 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ 固体Al(OH)3 | |
| D. | CH2═CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO}$CH3COOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: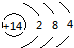 | |
| C. | N2分子的电子式: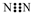 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
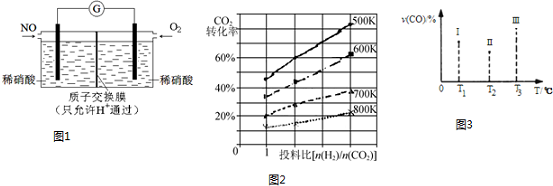
查看答案和解析>>
科目: 来源: 题型:解答题
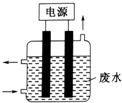 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: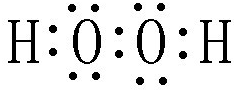 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com