
科目: 来源: 题型:解答题
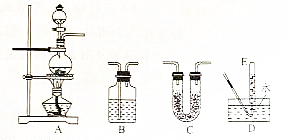
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| B | 饱和食盐水 |
| B | KBr溶液和CCl4的混合液 |
| D |
查看答案和解析>>
科目: 来源: 题型:解答题
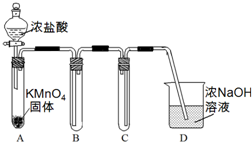 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
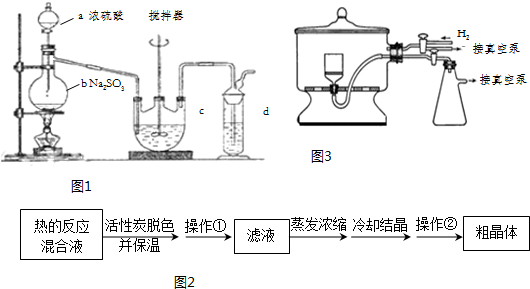
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
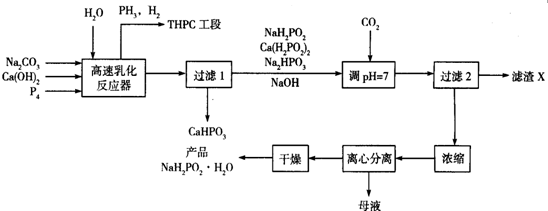
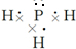 .
.查看答案和解析>>
科目: 来源: 题型:解答题
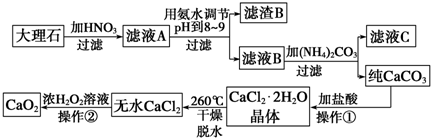
查看答案和解析>>
科目: 来源: 题型:填空题
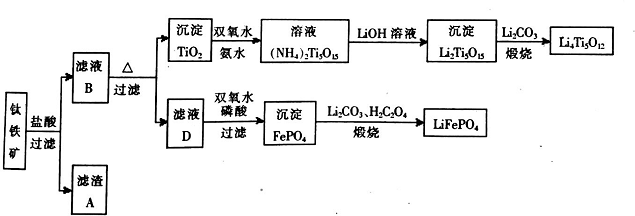
查看答案和解析>>
科目: 来源: 题型:填空题
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 滴定结束后,滴定管尖嘴处有一悬挂液滴 | |
| C. | 取NaOH溶液时先平视读数,后仰视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com