
科目: 来源: 题型:选择题
| A. | X原子的最外层电子数比Y原子最外层电子数多 | |
| B. | X的最高价氧化物水化物的酸性比Y的最高价氧化物水化物的酸性强 | |
| C. | 与H2化合时X形成的单质比Y形成的单质容易 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
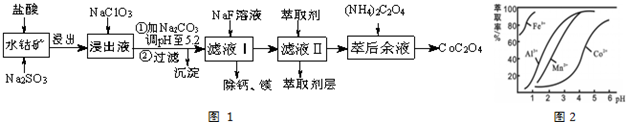
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 供电时的总反应是:2H2+O2=2H2O | |
| B. | 产物为无污染的水,属于环境友好电池 | |
| C. | 燃料电池的能量转化率无法达到100% | |
| D. | H2在负极发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 放热反应的发生无需任何条件 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数:Y>X | D. | 质子数:Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com