
科目: 来源: 题型:选择题
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤燃烧是热能转化为化学能的过程 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 | |
| D. | 化石燃料属于一次能源,电能属于二次能源 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+566.0kJ/mol | |
| C. | 含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热 | |
| D. | 1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目: 来源: 题型:解答题
 、
、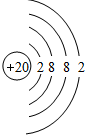 ,C的离子结构示意图
,C的离子结构示意图
 化学键类型为离子键.
化学键类型为离子键.查看答案和解析>>
科目: 来源: 题型:解答题

| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com