
科目: 来源: 题型:选择题
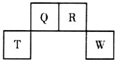 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液:Na+、AlO2-、OH-、NO3- | |
| C. | 0.1 mol•L-1NH3•H2O溶液:K+、Na+、NO3-、C1- | |
| D. | 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
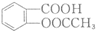 和
和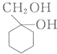 的流程路线.
的流程路线.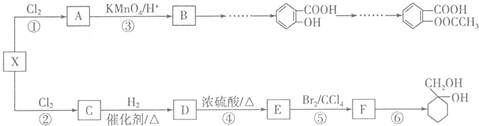
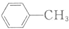 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$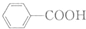
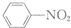 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$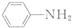 (苯胺,易被氧化)
(苯胺,易被氧化)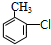 .
.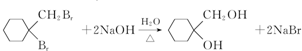 .
.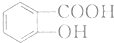 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式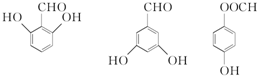 (任写一种).
(任写一种).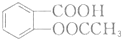 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.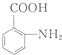 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
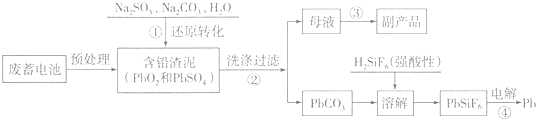
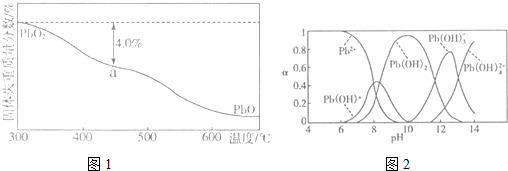
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
查看答案和解析>>
科目: 来源: 题型:选择题
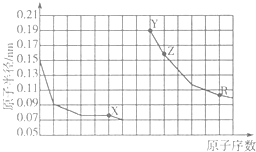
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目: 来源: 题型:选择题
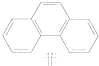
| A. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| B. | 分子式为C8H10,且属于芳香族化合物的同分异构体只有3种 | |
| C. | 菲的结构简式如右图,它与硝酸反应,所得一硝基取代物有5种 | |
| D. | 甲苯苯环上的一个氢原子被一C3H7取代,所得有机产物有6种 |
查看答案和解析>>
科目: 来源: 题型:解答题
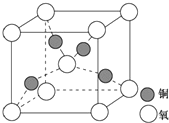 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu查看答案和解析>>
科目: 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
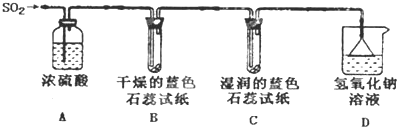
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com