
科目: 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
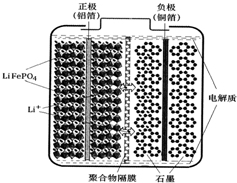 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.查看答案和解析>>
科目: 来源: 题型:选择题
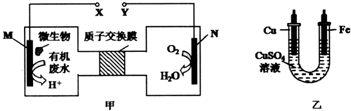
| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | X与Y互为同分异构体 | |
| B. | 可用酸性KMnO4溶液鉴别X和Y | |
| C. | 1molY能与6molH2或3mol NaOH发生反应 | |
| D. | 依曲替酯只能发生加成、取代、消去反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L庚烷的分子数约为NA | |
| B. | 1L 0.1mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA | |
| C. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| D. | 50mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
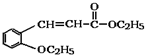 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为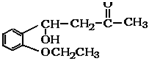 )其合成路线如图:
)其合成路线如图: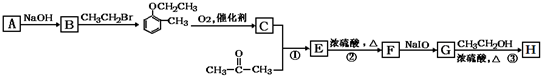
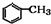 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$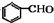
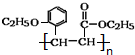 .
.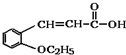 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$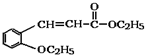 +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和.
有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com