
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
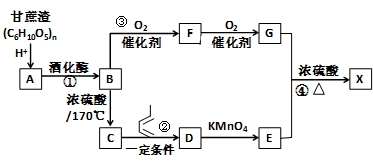

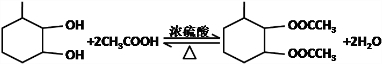 .
.
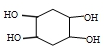 的合成路线为
的合成路线为 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目: 来源: 题型:解答题
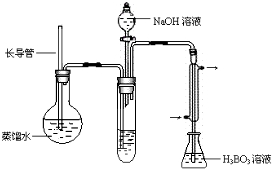
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.18 |
| 2 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.70 |
| 3 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.22 |
| 4 | x |
查看答案和解析>>
科目: 来源: 题型:选择题
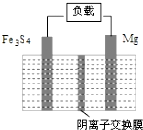 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的电离 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
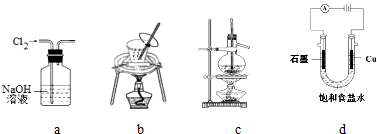
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置从饱和食盐水中提取氯化钠 | |
| C. | 用图c所示装置制取乙烯气体 | |
| D. | 用图d所示装置制取Cl2、H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
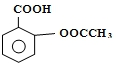 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com