
科目: 来源: 题型:解答题
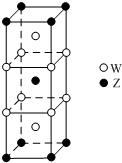 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.
短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于能层数.元素W位于第四周期,其基态原子所含未成对电子数在该周期中最多.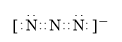 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
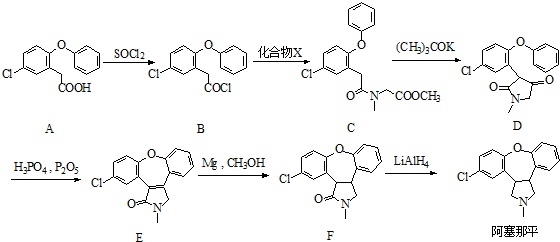
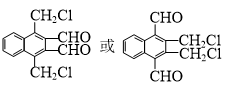 .
.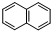 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;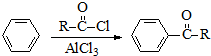 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和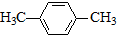 为原料制备
为原料制备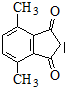 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目: 来源: 题型:选择题
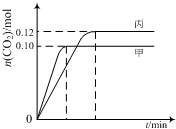 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO (g) | CO (g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40% |
查看答案和解析>>
科目: 来源: 题型:选择题
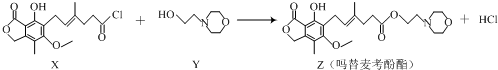
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| B. | 25℃时,向0.1 mol•L-1CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | Ba的金属活动性强于Mg,可以通过电解BaCl2溶液的方法获得金属钡 | |
| D. | 对硫酸工业中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
查看答案和解析>>
科目: 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铝熔点很高,可用于制造耐火坩埚 | |
| B. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| C. | 氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | |
| D. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com