
科目: 来源: 题型:选择题
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
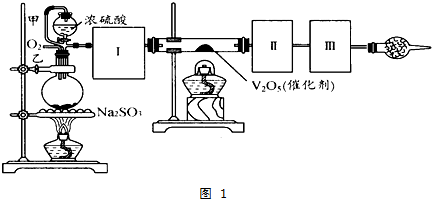
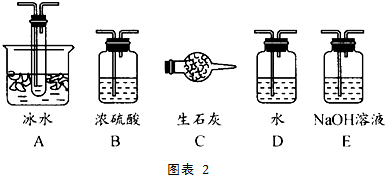
查看答案和解析>>
科目: 来源: 题型:解答题
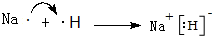 .
.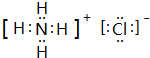 ,A2C2的电子式为
,A2C2的电子式为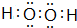 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为小于3NA | |
| B. | 0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA | |
| C. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA |
查看答案和解析>>
科目: 来源: 题型:填空题
 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com