
科目: 来源: 题型:解答题
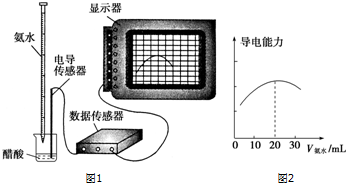
查看答案和解析>>
科目: 来源: 题型:解答题
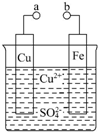 某小组为研究电化学原理,设计如图装置.回答下列问题:
某小组为研究电化学原理,设计如图装置.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
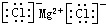 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
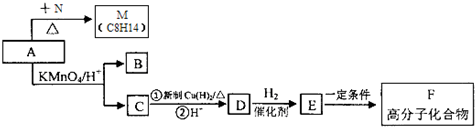
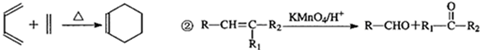
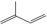 ,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构).
,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构). .
.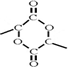 含有三元环:
含有三元环: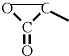 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH≡C-CH2CH3 丁炔 | B. | CH2═CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 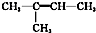 2-甲基丁烯 2-甲基丁烯 | D. | 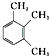 1,2,3-三甲苯 1,2,3-三甲苯 |
查看答案和解析>>
科目: 来源: 题型:解答题
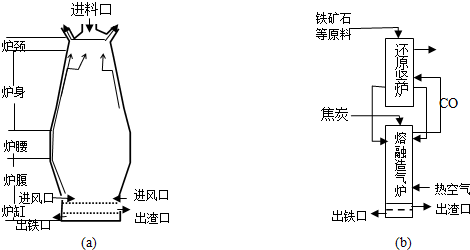
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 原子半径:R<Z<Y | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
查看答案和解析>>
科目: 来源: 题型:解答题
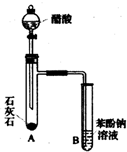 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.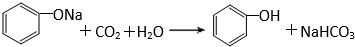 .
.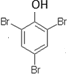 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com