
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl发生状态变化时,一定会破坏离子键 | |
| B. | 元素的非金属性越强,单质的活泼性一定越强 | |
| C. | 物质中分子间的作用力越大,分子越稳定 | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 1mol碳正离子(CH 3+)所含的电子总数为9NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在汽车排气管上加装“催化转化器”可以减少有害气体的排放 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物“,PM2.5在空气中有可能形成胶体 | |
| D. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗胃酸药物使用 |
查看答案和解析>>
科目: 来源: 题型:解答题
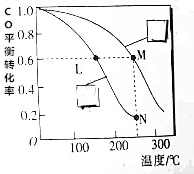 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:查看答案和解析>>
科目: 来源: 题型:解答题
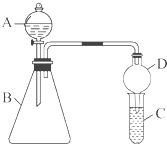 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com