
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
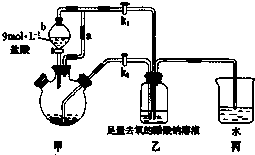 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH4O | CH2O | CH2O2 | C2H6 | C2H6O | C2H4O | C2H4O2 |
| A. | ①③④ | B. | ②④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,平衡常数增大 | |
| B. | 当v(CO2)正=$\frac{1}{2}$v(N2)逆时,说明反应达到平衡状态 | |
| C. | 增加CO的物质的量浓度,NO的转化率增大 | |
| D. | 增大压强,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
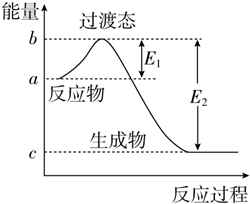 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com