
科目: 来源: 题型:解答题
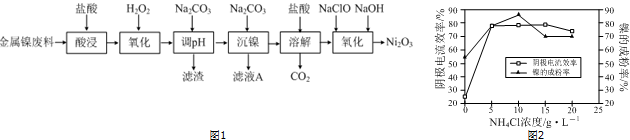
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
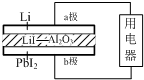 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2-2e-=Pb+2I- | |
| D. | b极质量减少1.27 g 时,a极转移的电子数约为6.02×1021 |
查看答案和解析>>
科目: 来源: 题型:选择题
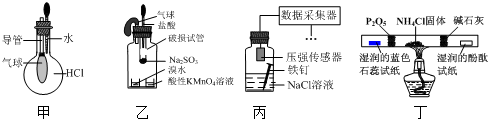
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
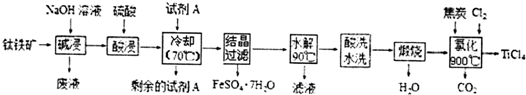
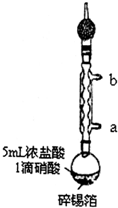 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题


| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com