
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
查看答案和解析>>
科目: 来源: 题型:解答题
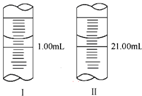 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.查看答案和解析>>
科目: 来源: 题型:实验题
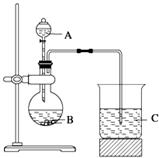
查看答案和解析>>
科目: 来源: 题型:解答题
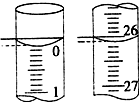 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:查看答案和解析>>
科目: 来源: 题型:解答题
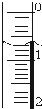 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
查看答案和解析>>
科目: 来源: 题型:计算题
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp(AgC1)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定,当溶液中c(Ag+)c(Cl- )<Ksp(AgCl)时,此溶液中必有AgCl沉淀析出 | |
| D. | 向AgI的悬浊液中加NaCl浓溶液,可能有AgCl生成 |
查看答案和解析>>
科目: 来源: 题型:解答题
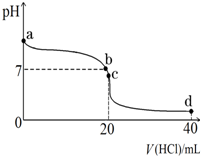 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com