
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
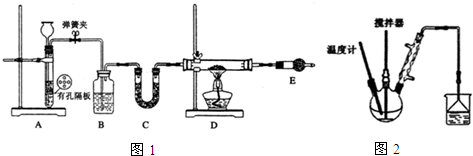
查看答案和解析>>
科目: 来源: 题型:解答题
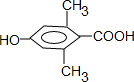
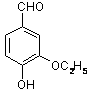 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.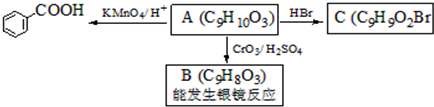
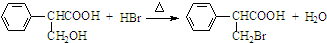 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).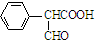 .
.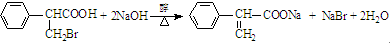 .
.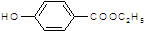 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用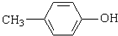 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
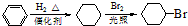
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
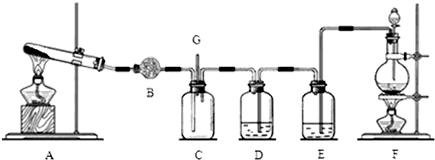
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com