
科目: 来源: 题型:解答题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
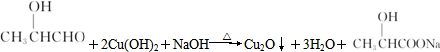 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
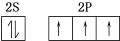 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
查看答案和解析>>
科目: 来源: 题型:解答题
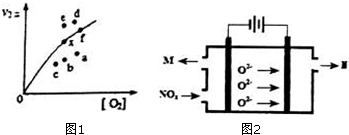 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知查看答案和解析>>
科目: 来源: 题型:解答题
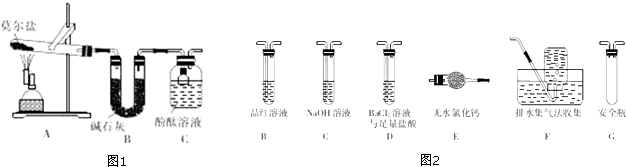
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
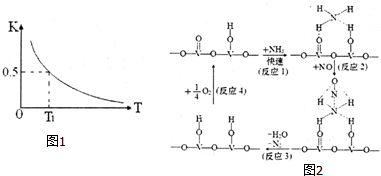 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 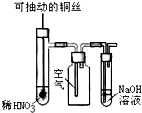 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com