
科目: 来源: 题型:选择题
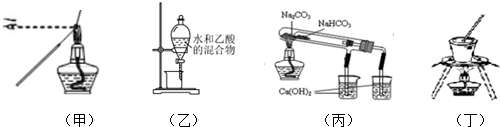
| A. | 甲图装置:用蘸有待测液的铁丝,检验K+ | |
| B. | 乙图装置:分离水和乙酸 | |
| C. | 丙图装置:验证NaHCO3和Na2CO3的热稳定性 | |
| D. | 丁图装置:从食盐水中提取食盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
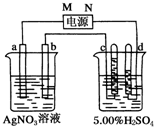 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl电子式:H:Cl | B. | S原子结构示意图: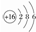 | ||
| C. | 10个中子的氧原子:${\;}_{8}^{18}$O | D. | CO2结构式:O═C═O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com