
科目: 来源: 题型:选择题
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
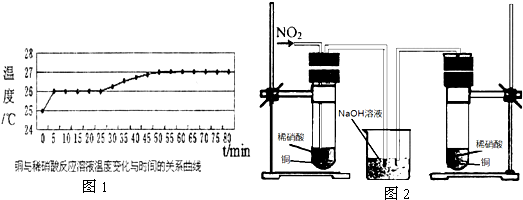
查看答案和解析>>
科目: 来源: 题型:解答题
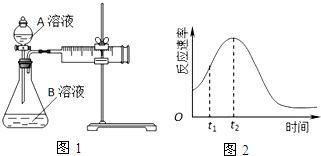
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目: 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
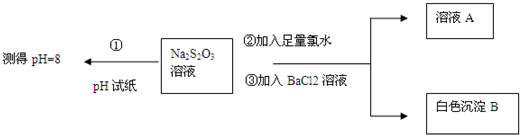
查看答案和解析>>
科目: 来源: 题型:填空题
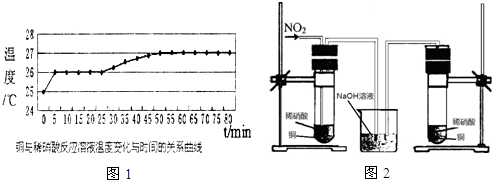
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com