
科目: 来源: 题型:解答题
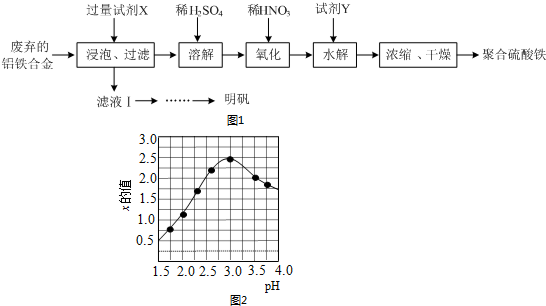

查看答案和解析>>
科目: 来源: 题型:解答题
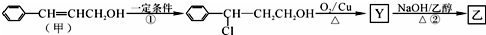
 .1mol乙最多可与5molH2反应.
.1mol乙最多可与5molH2反应.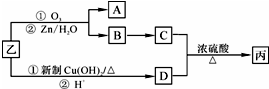
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.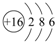 ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)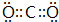 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸可以用于除去锅炉或水壶中的水垢 | |
| B. | 切开的苹果放置后变色和纸张久置后变黄的原理相同 | |
| C. | 蜂蚁蛰咬人时会向人体注入酸性物质,可涂抹小苏打溶液缓解疼痛 | |
| D. | 工业含酸废水可用氢氧化钡溶液处理后再排放,有利于减少水体污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素X与元素Y能形成离子化合物 | |
| B. | 原子序数为:X<Y<Z | |
| C. | 元素Z最高价氧化物对应水化物具有两性 | |
| D. | 元素Y形成的气态氢化物水溶液呈强酸性 |
查看答案和解析>>
科目: 来源: 题型:解答题
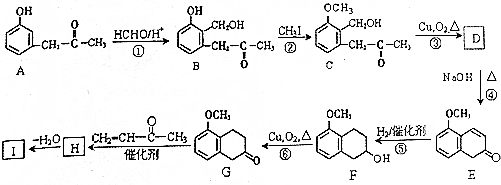
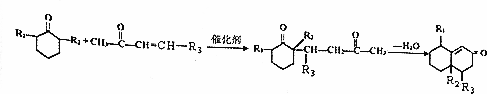
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2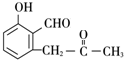 +2H2O.
+2H2O.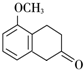 +
+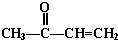 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$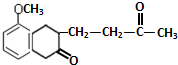 .
.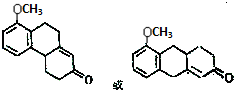 .
.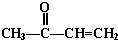 的流程图
的流程图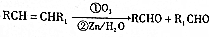 )
)查看答案和解析>>
科目: 来源: 题型:解答题
 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题: .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
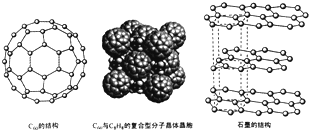
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60查看答案和解析>>
科目: 来源: 题型:解答题
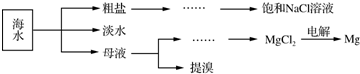
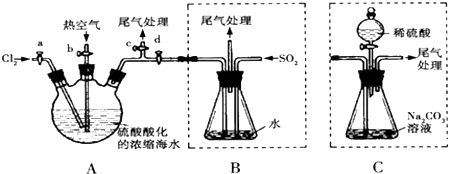
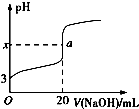
查看答案和解析>>
科目: 来源: 题型:选择题
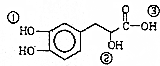
| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 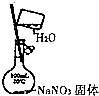 配置一定物质的量 浓度的NaNO3溶液 | |
| B. | 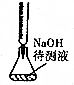 中和滴定 | |
| C. | 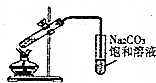 制备乙酸乙酯 | |
| D. | 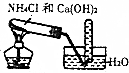 实验室制取氨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com