
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
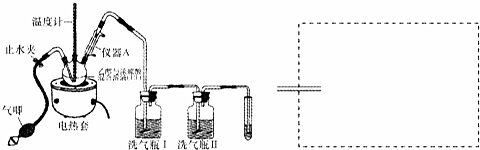
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe2O3中是否含有FeO | 向少量固体样品中加入适量稀硝酸溶解后,再滴加少量的高锰酸钾溶解 |
| B | 测定NaHCO3和NH4Cl固体混合物中NaHCO3 的质量分数 | 准确称取ag样品和坩埚总质量,加强热后在空 气中冷却至室温,再称量得到总质量为bg |
| C | 探究温度对化学平衡的影响 | 把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中 |
| D | 除去CO2气体中混有的少量HCl气体 | 将混合气体依次通过盛有饱和Na2CO3溶液和浓H2SO4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
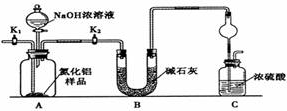
查看答案和解析>>
科目: 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.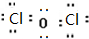 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4; 途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | 78gNa2O2中存在的共价键总数为NA(NA为阿伏伽德罗常数的值) | |
| D. | 18gD2O中含有的质子数为10NA(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室用氯化铝溶液和氨水制氢氧化铝:Al3++3OH-=Al(OH)3↑ | |
| B. | Al与NaOH水溶液反应产生气体:Al+OH-+2H2O=Al(OH)3↓+2H2↑ | |
| C. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com