
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
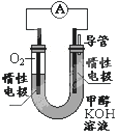 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
科目: 来源: 题型:解答题
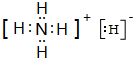 .
.查看答案和解析>>
科目: 来源: 题型:解答题
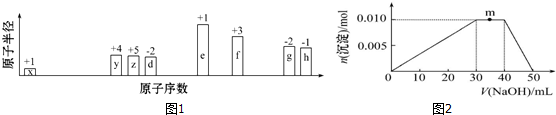
 (或
(或 、
、 ).
).查看答案和解析>>
科目: 来源: 题型:选择题
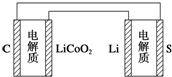 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠的电子式: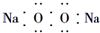 | |
| B. | 碳正离子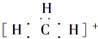 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: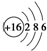 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com