
科目: 来源: 题型:解答题
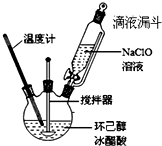 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.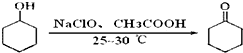
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
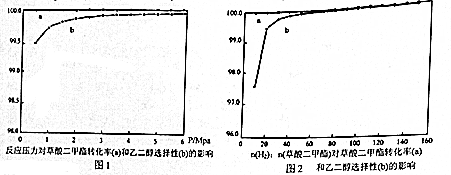
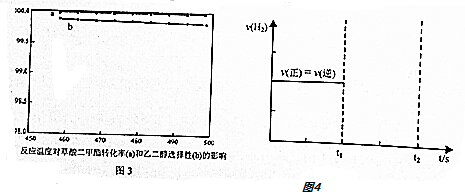
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得.
乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得. 不稳定,会自动转化R-CH2CHO.请回答:
不稳定,会自动转化R-CH2CHO.请回答: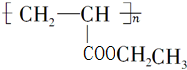 .
.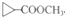 是D的一种同分异构体
是D的一种同分异构体查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分馏石油气和裂解气可用溴水进行鉴别 | |
| B. | 异丁烷的二氯取代物有3种(不考虑立体异构) | |
| C. | 主链含四个碳的烷烃中,碳原子个数是最多的是2,3-四甲基丁烷 | |
| D. | 乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸 | |
| B. | 达到滴定终点后,静置1~2min再读数,主要是为了防止管壁有液体残留引起误差 | |
| C. | 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用普通玻璃棒进行搅拌,准确读取反应前后温度、取2~3次的实验平均值 | |
| D. | 某溶液可能含有SO42-和Cl-,可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银,来检验其中的Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用贮氢金属和氢气反应生成氢化物的方法,为解决氢气的贮存问题指明了方向 | |
| B. | 科学家发现纳米硒除荧光灯的残汞效果非常好,可见纳米硒的非金属性比一般的硒强 | |
| C. | 在人类对酸碱认识的发展过程中,提出的酸碱质子理论不但适用于水溶液,在非水溶液和无水条件下也适用 | |
| D. | 为了使加酶洗衣粉有良好的洗涤效果,可先用温水溶解洗衣粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com