
科目: 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: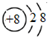 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
查看答案和解析>>
科目: 来源: 题型:实验题
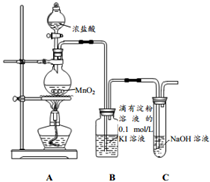 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 序号 | 实验操作示意图 | 实验现象 |
| Ⅰ | 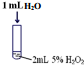 | 有极少量气泡产生 |
| Ⅱ | 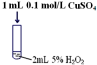 | 产生气泡速率略有加快 |
| Ⅲ | 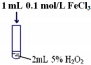 | 产生气泡速率明显加快 |
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| v(O2)mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
查看答案和解析>>
科目: 来源: 题型:填空题
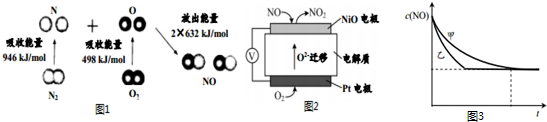
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com