
科目: 来源: 题型:选择题
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
查看答案和解析>>
科目: 来源: 题型:选择题
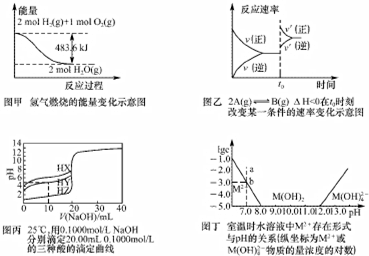
| A. | 由图甲可知:H2的燃烧热为241.8kJ/mol | |
| B. | 由图乙可知:t0时刻改变的条件是增大压强或者升高温度 | |
| C. | 由图丙可知:将上述HX、HY、HZ溶液等体积混合,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度:c(Z-)>c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 由图丁可知:室温时M(OH)2(s)的溶度积常数为1.0×10-17 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
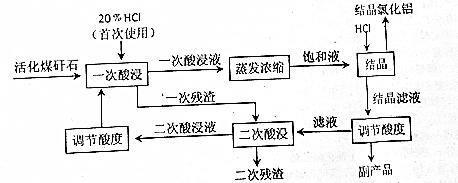
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com