
科目: 来源: 题型:解答题
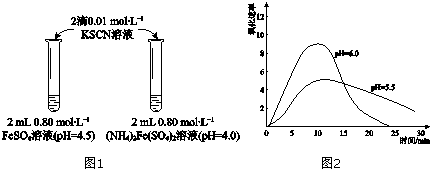
| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
查看答案和解析>>
科目: 来源: 题型:解答题
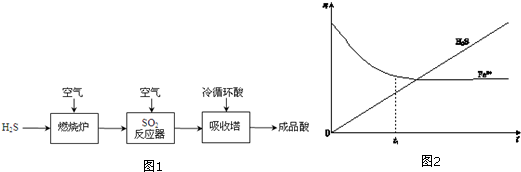
查看答案和解析>>
科目: 来源: 题型:选择题
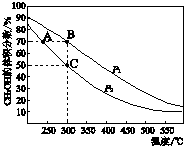 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 主要成分为NaCl、NaClO和NaHCO3 | B. | c(Cl-)=c(ClO-) | ||
| C. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)=c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目: 来源: 题型:选择题
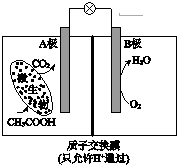
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有②③⑦ | C. | 只有①③⑥ | D. | 只有⑤⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com