
科目: 来源: 题型:解答题
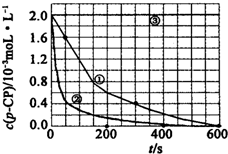 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):| 实验序号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照物 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 10 | 6.0 | 0.30 | |
| c(I-)/(mol•L-1) | c(Fe3+)/(mol•L-1) | v/(mol•L-1•s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目: 来源: 题型:选择题
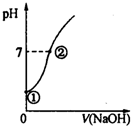 常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | 水的电离程度:①>② | |
| C. | I-在②点所示溶液中能稳定存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
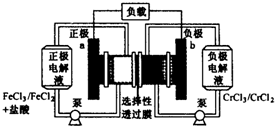 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用合成聚碳酸酯可降解塑料,可以减少“白色污染” | |
| B. | 用蘸有浓氨水的棉棒可以检验输送氯气的管道是否漏气 | |
| C. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| D. | 推广矿物燃料脱硫脱硝技术,能有效减少二氧化硫和氮氧化物的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
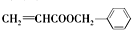 .
.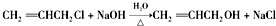 .
.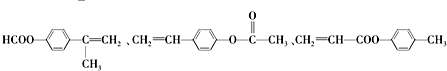 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
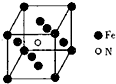 氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.
氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.| 性质 | 第一电离能 | 熔点 | 半径 | 键能 |
| 对象 | S<Cl | Na<Al | N3->Al3+ | N=N<N≡N |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)=0.1 mol•L-1 | |
| B. | 0.2 mol•L-1NaHS溶液和0.1 mol•L-1Na2S溶液等体积混合,混合液中:3c(Na+)=4c(H2S)+4c(HS-)+4c(S2-) | |
| C. | KAl(SO4)2的水溶液中:c(SO42-)>c(A13+)>c(K+)>c(H+)>c(OH-) | |
| D. | H2SO3溶液中:c(H+)=2c(SO32-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
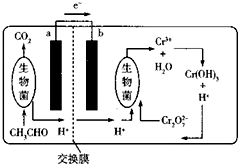 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com