
科目: 来源: 题型:选择题
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
查看答案和解析>>
科目: 来源: 题型:填空题
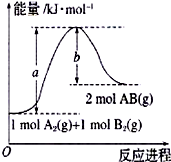 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目: 来源: 题型:解答题
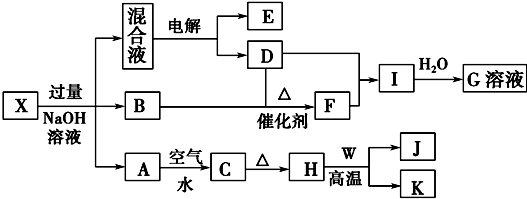
查看答案和解析>>
科目: 来源: 题型:解答题
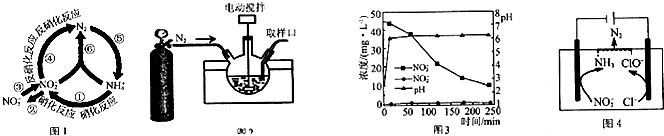
查看答案和解析>>
科目: 来源: 题型:解答题
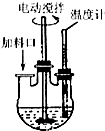 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目: 来源: 题型:解答题
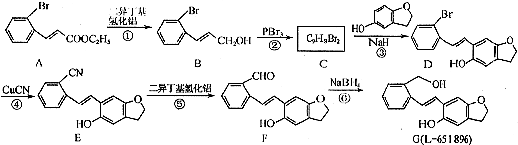
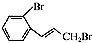 .
.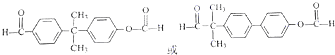 (只写一种).
(只写一种).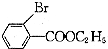 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图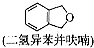 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目: 来源: 题型:多选题
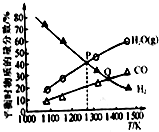 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
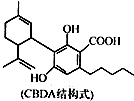
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com