
科目: 来源: 题型:解答题
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
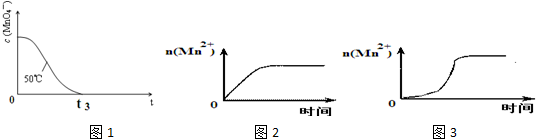
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 试管A | 试管B | |
| 加入试剂 | ||
| 实验现象(褪色时间) | ||
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
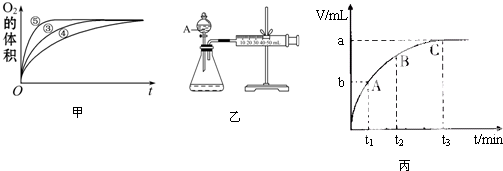
查看答案和解析>>
科目: 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题
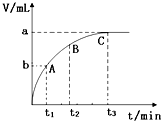 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8gNa2S晶体中含有的S2-数目小于0.1NA | |
| B. | 1.68g铁与足量水蒸气反应,转移的电子数目为0.09NA | |
| C. | 11g由31H和168O组成的超重水中,含有的中子数目为5NA | |
| D. | 与17gH2O2所含非极性键数目相同的N2H4的分子数目为0.5NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com