
科目: 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,原子半径从大到小(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于5s | B. | 等于10s | C. | 大于10s | D. | 小于10s |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增加铁粒质量 | B. | 换成同浓度的稀硫酸 | ||
| C. | 改成98%的浓硫酸 | D. | 加入纯硝酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
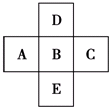
查看答案和解析>>
科目: 来源: 题型:解答题
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com